Notre mémoire… protéique, ... Annexes
Mis à jour le 18 /06/2023
Certaines protéines nommées enzymes catalysent les réactions biochimiques ;
des protéines soutiennent les parois des cellules ;
des protéines sont des moteurs ou des transporteurs intracellulaires ;
des protéines agissent dans la communication hormonale ;
les anti-corps, des agents du système immunitaire, sont aussi des protéines, etc.
Vous pouvez aller consulter "Protéine" sur Wikipédia, dont j'ai utilisé plusieurs figures

... mais pour faire plus court, je reprends, ... en la complétant, la définition de Jean Rostand & Andrée Tétry sur la structure de protéines.
« Les protéines, … , possèdent quatre niveaux de structures.

La structure primaire correspond à l’enchaînement des acides aminés.
La liaison peptidique s'effectue par le groupe amine - bleu - d'un acide aminé avec le groupe carboxylique - rouge- de l'acide aminé suivant
Les protéines sont à la fois homogènes et hétérogènes.
- La chaîne constituée par l’enchaînement des liaisons peptiques est bien homogène,
- mais les fonctions latérales apportent une hétérogénéité qui différencie les protéines les unes des autres.
/image%2F2354072%2F20230622%2Fob_b37a64_perles-baroques.jpg)
Comme un collier de perles, ...
/image%2F2354072%2F20230622%2Fob_bd75c6_perles-baroques-02.jpg)
...mais de perles baroques, qui sont chacune différente.
En effet, les acides aminés se différencient par leur fonction latérale ( R jaune-brun sur le schéma)
Les acides aminés qui constituent les protéines (dit « acides aminés protéinogènes ») sont au nombre de 20 (dans le collier, il n'y a que 20 perles baroques différentes) ...
... auxquels il faut ajouter quelques acides aminés spécifiques de certaines protéines.

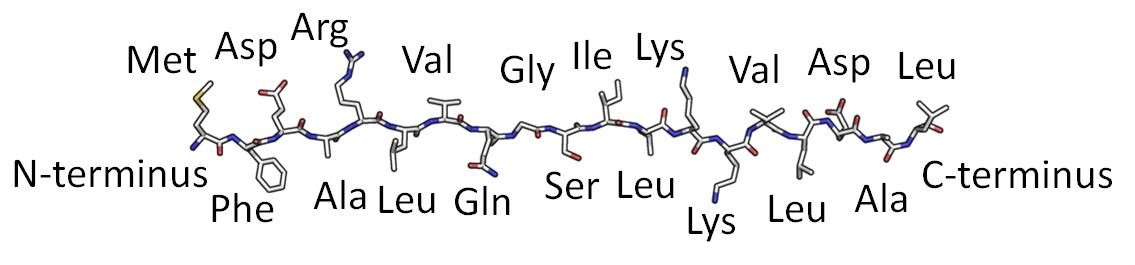
Pour la protéine de la figure ci-contre, la structure primaire, est l'enchaînement de gauche à droite, de la méthionine Met; de la phénylalanine, Phe; de l'acide aspartique Asp; le l'alanine, Ala; etc.
Les degrés supérieurs d’organisation permettent une
- certaine compartimentation de l'hétérogénéité des protéines (voir 11. Notre mémoire et l’écho ferroélectrique )
- qui place la majorité des fonctions latérales ( R ) hydrophiles (ou "polaires") à la périphérie et une majorité de fonctions latérales hydrophobes vers l’intérieur. La majorité, mais pas toutes ! Les fonctions latérales hydrophobes se retrouvant en surface jouent un rôle essentiel dans dissolution/agrégation des protéines.
... la même molécule de protéine renferme toujours le même nombre et les mêmes acides aminés, enchaînés suivant une séquence stable.
Ce « toujours » est loin d'être absolu, voir épissage alternatif ci-dessous

Chaque acide aminé a la possibilité de tourner autour de la liaison peptidique, considérée comme une « charnière ».
Ces mouvements permettent de privilégier certaines structures répétitives
La structure secondaire est constituée par l'arrangement répétitif de la chaîne polypeptidique,

Les enroulements hélicoïdaux (hélices alpha) sont nombreusx dans l’hémoglobine (voir figure tournante ci-contre).
Des structures plissées (voir Kératine beta du gecko) font également partie de la structure secondaire ainsi que des structures …
... non régulières conférées "seulement" par la limite mécanique des "charnières"
/image%2F2354072%2F20230218%2Fob_1472c1_humid-random-coil.jpg)
Cette structure "sans structure" (random coil) permet de relier entre elles les hélices et/ou les structures plissées (figure ci-contre), elle se retrouve en grande proportion dans les protéines protéiformes et en faible proportion dans les protéines de ... structure, comme les kératines.
La structure tertiaire est formée par les replis, souvent fort complexes (et dynamiques), des structures primaires et secondaires.
Cette organisation permet une certaine compartimentation de l'hétérogénéité des protéines (voir 11. Notre mémoire et l’écho ferroélectrique ) qui place la majorité des fonctions latérales ( R ) hydrophiles (ou "polaires") à la périphérie et une majorité de fonctions latérales hydrophobes ("apolaires) vers l’intérieur.
La majorité, mais pas toutes ! Les fonctions latérales hydrophobes se retrouvant en surface jouent un rôle essentiel dans dissolution/agrégation des protéines.
Enfin la structure quaternaire, existante chez diverses protéines, comporte l’association entre elles de plusieurs chaînes polypeptidiques ; elle aboutit à un édifice moléculaire. »

Une façon de se représenter cet édifice moléculaire est de malaxer dans sa main environ un ou deux mètres de laine à tricoter jusqu’à obtenir une boule … protéiforme. Vous pourrez à l'occasion aussi apprécier la plasticité de la boule de laine ainsi formée.
Or, la laine de mouton est justement constituée d'une protéine, la kératine
Parmi les protéines de la figure ci-dessous, la dernière à droite, la torique, est celle qui retiendra le plus notre attention pour les protéines de mémoire.

La conformation spatiale d'un protéine fonctionnelle n'est pas toujours (et même rarement) la plus thermodynamiquement probable.
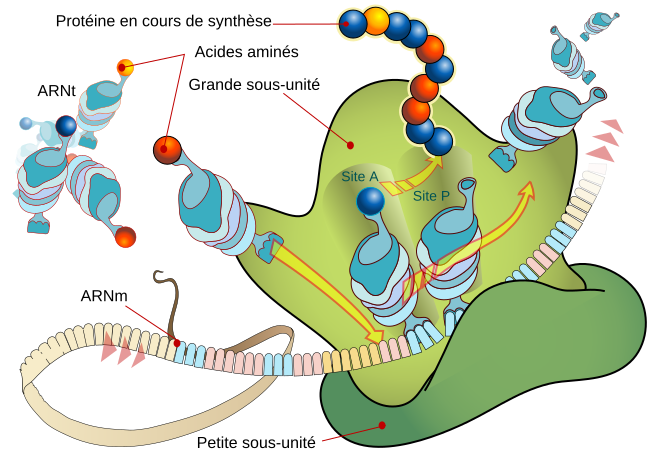
La structure d'une protéine à la sortie du système ribosomal (l'usine à protéine de la cellule) doit le plus souvent être mise dans sa conformation "active" par une protéine chaperon .
L’ADN code des gènes, et l’expression de ces gènes conduit à la synthèse de protéines.
Une fois la machinerie (ribosomiale ci-dessus) lancée, de nombreuses protéines, identiques à la première, sont fabriquées « à la chaîne ».
/image%2F2354072%2F20230617%2Fob_9c712e_immuniglobuline-memoire.jpg)
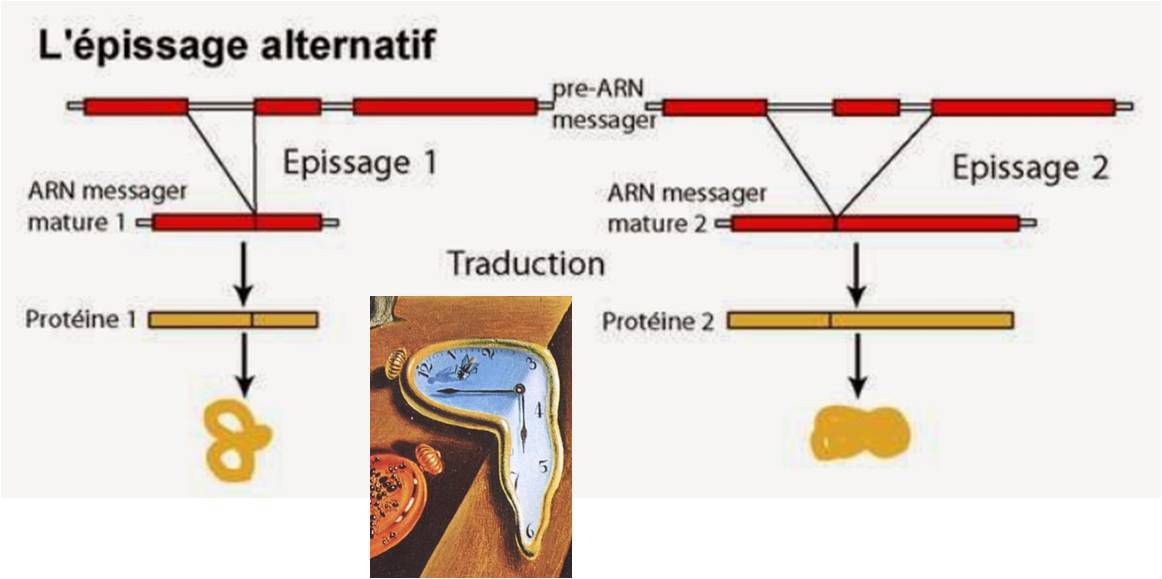
Le principe général selon lequel « une protéine = un gène » .... ne s'applique ni aux protéines du système immunitaire acquis (voir exemple ci-contre) ni aux protéines mnésiques.
Pour ces systèmes, des protéines de différentes natures (plus de 2 000 ?) peuvent être exprimées à partir d’un seul gène par épissage alternatif.
La plasticité est une propriété mécanique essentielle des protéines.
Les catalyses enzymatiques n’auraient pas lieu sans la plasticité qui permet un changement de conformation qui elle même favorise la catalyse.
La plasticité des protéines de mémoire pourrait bien jouer un rôle fondamental dans toutes les fonctions cognitives.

Le sens de plastique utilisé ici est proche de malléable, de déformable sous l'action d'une force extérieure comme …
… l’argile façonnée par le potier
… ou mieux un chewing-gum

Un chewing-gum change de conformation sous l'action de l'énergie mécanique de la mastication ...

... et même du souffle pour obtenir une bulle.
La plasticité est un phénomène irréversible, contrairement à l’élasticité
Sous l’effet d’une contrainte extérieure, le matériau est d’abord élastique, puis plastique.
Au delà, si la contrainte dépasse un certain seuil, elle provoque la cassure du matériau.
La plasticité est la conséquence de la rupture des liaisons faibles puis la reconstitution d’une nouvelle structure apportée par d’autres liaisons faibles.
Si des liaisons se créent avec des d’autres atomes voisins, y compris ceux de l’eau environnante, de molécules hydrophiles, d’ions libres, etc. le matériau est dans sa phase de plasticité.
Si les liaisons initiales se reforment, le matériau reprend la même forme, le matériau est dans sa phase d’élasticité.

Par exemple comme après s’être pincé la joue. Les protéines de structure comme l’élastine et le collagène permettent un retour à la joue initiale.
L’élasticité ayant ses limites, quand le seuil de rupture est attent, des rides d’expression peuvent apparaître, mais c’est une autre histoire !
La plasticité peut être représentée comme une mobilité moléculaires des chaînes protéiques les unes par rapport aux autres. Selon l’approche de Ree-Eyring, la plasticité pourrait se décrire par l’écoulement visqueux entre les chaînes. On peut alors parler de "viscoplasticité".
Si une protéine est plastique c’est que les atomes constitutifs de cette protéine bénéficient d’une certaine mobilité.
Cette mobilité est limitée par des liaisons internes très énergétiques comme les liaisons covalentes (celles des liaisons peptidiques qui forment la structure primaire des protéines) ou aussi les liaisons ioniques dans un environnement hydrophobe, etc.
À l’inverse, des liaisons de faible énergie comme les liaisons hydrogène, et aussi les liaisons ioniques dans un environnement hydrophile, les liaisons entre zones hydrophobes, etc. peuvent se rompre facilement et conférer une grande mobilité à la protéine
Les liaisons fortes ne se rompent pas, elles limitent les déplacements, et les atomes, groupes d’atomes peuvent effectuer des rotations autour de l’axe constitué par ces liaisons. Par ailleurs, les angles de valence (entre deux liaisons covalentes) ont une certaine flexibilité conformationnelle.
Le changement de structure d'une protéine (plastique) peut avoir pour origine différents facteurs comme :

- un changement de son environnement, par exemple la quantité d’eau comme-de-la-glace disponible.
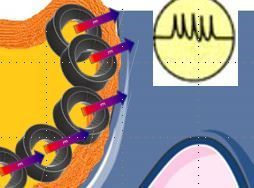
- un changement vers un environnement lipophile comme l’intégration, même en partie, de la protéine dans une membrane plasmique, par exemple celle des astrocytes. Ce changement est consécutif au passage depuis l’intérieur de la cellule (le cytosol) vers la membrane. Phénomène de "translocation" = trans-localisation.
- Un champ électrique comme celui généré par le flux électrique neuronal (voir Enregistrement de notre mémoire) ou celui associé au vecteur électrique associé à une protéine voisine (devenant un champ électrique extérieur E)

- simplement du hasard ou la probabilité entropique. Ce qui fait entrer (déjà par cette porte) dans le domaine de la mécanique probabiliste.
/image%2F2354072%2F20210508%2Fob_e30693_capture-d-ecran-2021-05-07-181941.jpg)
La force extérieure peut aussi être mécanique comme la main du potier, les mâchoires du mâcheur de chewing-gum.
Une contrainte mécanique sur un matériau électrodéformable, comme les protéines du toucher, peut aussi "produire" de l’électricité, comme la piézoélectricité. (voir Les transducteurs de notre mémoire).
À la température de la vie les protéines se déforment spontanément avec une certaine probabilité (phénomène probabiliste).
Ces modifications structurales aléatoires sont largement fonction de la température et de l’environnement de la protéine. Ces déformations ne cessent que quand la protéine est cristallisée,
(même bien mâché, mis au réfrigérateur, un chewing-gum devient dur !).
Les protéines offrent un vaste champ de propriétés élastiques et plastiques
Certaines protéines sont moins plastiques, comme les protéines de structure (par exemple : l’élastine, le collagène, la kératine), d’autres sont très plastiques, comme les protéines « de signalisation » et certainement les protéines de mémoire.
/image%2F2354072%2F20230620%2Fob_cd1f1d_os.jpg)
Même des protéines apparemment rigides comme celle des os, possèdent une certaine plasticité (qui leur permet d’être hystérétiques)
/image%2F2354072%2F20230710%2Fob_98051d_intrinsequement-desordonnee.jpg)
Les protéines les plus plastiques sont qualifiées « intrinsèquement désordonnées ». Voir l’article de Richard Kriwacki)
Ces protéines contiennent au moins certaines régions non repliées, ou désordonnées.
Elles se transforment constamment sous l’action du mouvement brownien et de leur propre agitation thermique, et pourtant elles restent parfaitement fonctionnelles.
Ces protéines effectuent leurs tâches sans jamais se replier complétement et que certaines se replient uniquement quand cela est indispensable, notamment lors de la liaison, du « rendez-vous », avec un partenaire spécifique (une autre protéine, un acide nucléique, de petites molécules, etc.)
Certaines des merveilles du désordre intrinsèque des protéines sont discutées comme illustrations de leur (méta)physique « mystérieuse », dans la revue de Vladimir Uversky parue dans Frontiers.
La conclusion donnée montre parfaitement l’étendue de la complexité de la plasticité des protéines
Chaos réglable
Étant des systèmes biologiques complexes qui sont apparemment positionnés au bord du chaos, les protéines intrinsèquement désordonnées ne sont pas des entités complétement aléatoires, car elles ont évolué pour avoir des propriétés ajustables, contrôlables, régulables, accordables et, souvent, très spécifiques requises pour leurs fonctions biologiques.
De plus, la nature elle-même utilise divers moyens (tels que différentes modifications post-traductionnelles, mutations, épissage alternatif et interaction avec de nombreux partenaires de liaison de nature physico-chimique différente) pour régler les propriétés fonctionnelles des protéines intrinsèquement désordonnées.
La complexité du désordre intrinsèque est encore renforcée par le fait que les différentes parties d'une protéines intrinsèquement désordonnée ne sont pas toujours complétement indépendantes, mais peuvent « ressentir » et répondre à diverses parties voisines.
En conséquence, différentes régions d'une protéine intrinsèquement désordonnée peuvent subir des changements induits involontaires qui représentent une sorte d'effet secondaire des changements souhaités des régions cibles.

Certaines fonctions latérales des acides aminés constitutifs des protéines (la structure primaire) sont électriquement chargées.
Les fonctions latérales lysine, arginine et histidine présentent une charge cationique (charge positive +)
L’acide aspartique et l’acide glutamique présentent des charges anioniques (charge négative -)
Auxquels s’ajoutent la charge anionique et cationique des acides aminés placés en bout de chaque chaîne peptidique.
Ces charges, notamment ...
/image%2F2354072%2F20230601%2Fob_217cc8_his-protonation-03.jpg)
... celle de l’histidine ci-contre, sont sensibles
- à l’environnement ionique (dont il est convenu de nommer pH local mais qui correspond à la plus ou moins grande présence de proton H+)
- à la présence d’ion bivalents comme le calcium (ce dernier étant souvent un cofacteur de métabolisme),
- …
Une fois la structure quaternaire formée, un certain nombre de charges persistent et sont réparties dans l'espace. Cette répartition diffère selon la nature de la protéine et sa conformation.
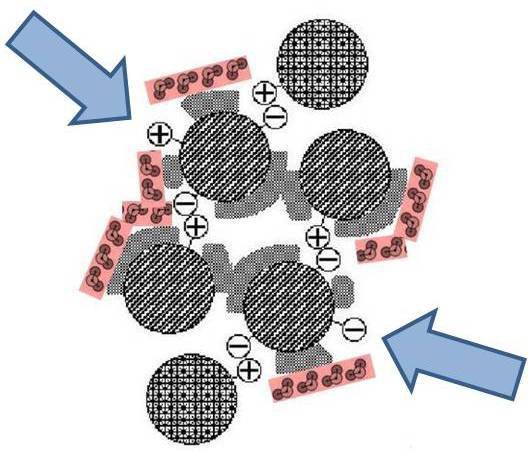
Schématiquement (en coupe) ci-contre, deux charges sont persistantes après l’assemblage de deux trios de kératine-1, kératine-10 et de filaggrin (voir Kératinisation et eau-comme-de-la-glace)
/image%2F2354072%2F20210510%2Fob_ff7b6f_capture-d-ecran-2021-05-10-102013-t.jpg)
La tropoélastine est une protéine précurseur de l’élastine, elle-même protéine de structure qui confère son élasticité au derme, aux vaisseaux sanguins, aux ligaments, à certains tendons, ….
La représentation ci-dessous de la (tropo)élastine selon la publication d’Antonio Mario Tamburro, Antonietta Pepe et Brigida Bochicchio), montre les structures en hélice alpha
/image%2F2354072%2F20230604%2Fob_df52d5_tambur-elastine.jpg)
/image%2F2354072%2F20230603%2Fob_a3b72f_elastine-charges-02.jpg)
La figure ci-contre (empruntée à l’équipe de Jiangyu Li de l’Université de Washington; Seattle, USA) représente les charges ioniques d'une des conformations de la tropoélastine.
Plus la couleur est bleue, plus la charge est négative, plus la charge est rouge, plus elle est positive, selon la gamme de couleurs ci-dessous.
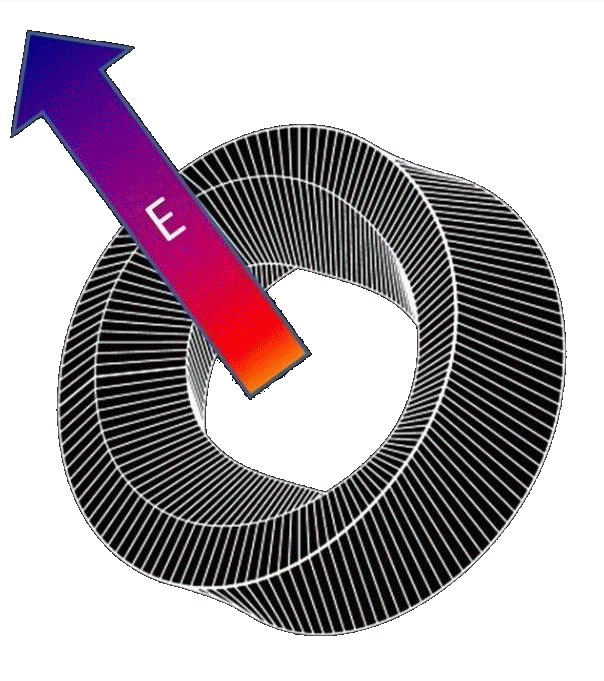
La non coïncidence des barycentres des charges positives et négatives des protéines forment un dipôle électrostatique équivalent et qui peut être représenté par un vecteur (flèche E ), ici dans l'exemple d'une protéine torique.
Le dessin du vecteur est une "vue d'artiste"
/image%2F2354072%2F20230604%2Fob_a5e1e3_eau-proteines.jpg)
Comparé à celui de la molécule d’eau, considéré pourtant comme « très » polaire, le champ électrique (moment dipolaire) associé aux protéines, comme ici l'élastine, peut être de plusieurs centaines de Debyes.
/image%2F2354072%2F20230604%2Fob_082671_eau-molecule.jpg)
Celui de l’eau n’est que de 1,85 Debye
L’élastine est, à ma connaissance, la seule protéine dont le champ électrique ait été mesuré.
Par contre, le dipôle de nombreuses protéines a été déterminé in silico, c'est à dire par des calculs informatiques, (http://bip.weizmann.ac.il/dipol).
/image%2F2354072%2F20230617%2Fob_ddc981_table-1-partiel-champs-sussman.jpg)
Table 1, partielle, selon Joel Sussman et ses collègues (Department of Structural Biology, Weizmann Institute of Science, 76100 Rehovot, Israel) donnant quelques valeurs, en debyes, des moments de dipôles/vecteurs de quelques protéines.
On notera
- des valeurs élevées, 540 et 465 Debyes pour, respectivement la Bovine a-chymotrypsin et la Bovine y-chymotrypsin. Ces valeurs correspondent aux valeurs moyennes des moments dipolaires des protéines
/image%2F2354072%2F20230618%2Fob_ea57c9_desoxyh.jpg)
- des valeurs très différentes, 45 et 271 D, ont été calculées pour l’Human deoxy-hemoglobin et Human oxy-hemoglobin
(13). Antosiewicz,J. and Porschke,D. (1989) The nature of protein dipole moments: experimental and calculated permanent dipole of alphachymotrypsin. Biochemistry, 28, 10072–10078.
(14). Antosiewicz,J. and Porschke,D. (1995) Electrostatics of hemoglobins from measurements of the electric dichroism and computer simulations. Biophys. J., 68, 655–664.
Le moment dipolaire peut atteindre des valeurs beaucoup plus importantes.
/image%2F2354072%2F20230617%2Fob_bdda4b_septine.jpg)
Dans l’étude d’un complexe de septines (protéines du groupe des GTP-binding proteins) Kenneth Swanson et ses collègues notent un moment dipolaire calculé élevé de 2711 Debyes (POS)qui jouerait un rôle physiologique central, , entrant dans le traitement des tumeurs.
Pour un exemple en 3D, voir le représentation de la TAQ RNA polymerase. fig 2 C.
(les TAQ polymérases sont utilisées pour l'amplification dans la PCR, polymerase chain reaction).
/image%2F2354072%2F20230617%2Fob_4a8ce0_taq-polymerase.jpg)
Joel Sussman rapportent l’exemple d’une enzyme et de son inhibiteur, également protéique, pour lesquels « les moments dipolaires de l'inhibiteur et de l'enzyme sont alignés dans la même direction. »
/image%2F2354072%2F20230617%2Fob_503825_veteurs-meme-direction.jpg)
Il est vrai que des vecteurs dont les mêmes charges sont côte à côte doivent s’influencer (comme deux aimants magnétiques).
L’un jouant le champ électrique extérieur de l’autre, les polarisations et les conformations de chacune des protéines sont certainement modifiées, voir la courbe d'hystérésis du § Ferroélectricité des protéines
Paul Brinkkoetter et Thomas Benzing donnent l’exemple de la variation du module pour deux protéines la podocine et la stomatine (toutes deux impliquées dans la filtration par le rein) lors de la dimérisation.
/image%2F2354072%2F20230710%2Fob_9a4b18_mono-dimer.jpg)
Dans ces deux exemples, les modules du monomère de différent pas sensiblement de ceux du monomère, ils sont même légèrement inférieurs, laissant penser que la dimérisation provoque des neutralisation de charges ioniques
/image%2F2354072%2F20230618%2Fob_d462aa_phosphoryl-01.jpg)
La phosphorylation d’une protéine est la fixation d’un groupe phosphoryl PO32−, sur des fonctions latérales de sérine/thréonine.
Avec ses deux charges anioniques, le phosphoryl modifie fortement la répartition des ions de la protéine, donc le vecteur ferroélectrique qui lui est associé, aussi bien dans son module que dans sa position dans l’espace.
Paul Brinkkoetter et Thomas Benzing donnent l’exemple de la variation du module pour deux protéines la podocine et la stomatine (toutes deux impliquées dans la filtration par le rein). Pour ces deux protéines, le module est fortement augmenté par la phosphorylation.
/image%2F2354072%2F20230618%2Fob_fd8600_phosphoryl-03.jpg)
Si c’était par ses modifications du vecteur ferroélectrique que la phosphorylation provoquait les changements biochimiques des protéines ?
/image%2F2354072%2F20230703%2Fob_7151e7_gymnote-anguille.jpg)
Selon Kenneth Catania, le gymnote (anguille électrique) constitue un dipôle électrique, la tête étant le pôle positif.
Si un animal entier peut constituer un dipôle, pourquoi pas une protéine ?
… ou « Protéines hystérétiques »
Hystérésis : Phénomène par lequel la polarisation d'une substance soumise à un champ électrique dépend, non seulement de l'intensité actuelle de ce champ, mais aussi de ses valeurs antérieures, voir courbe ci-dessous
C’est par analogie que le qualificatif de ferroélectrique a été appliqué aux protéines (lors de la découverte de ces propriétés, dans les années quarante).
Pour être hystérétique, un matériau, un objet, un cristal, un polymère, une protéine, … doit cumuler deux propriétés :
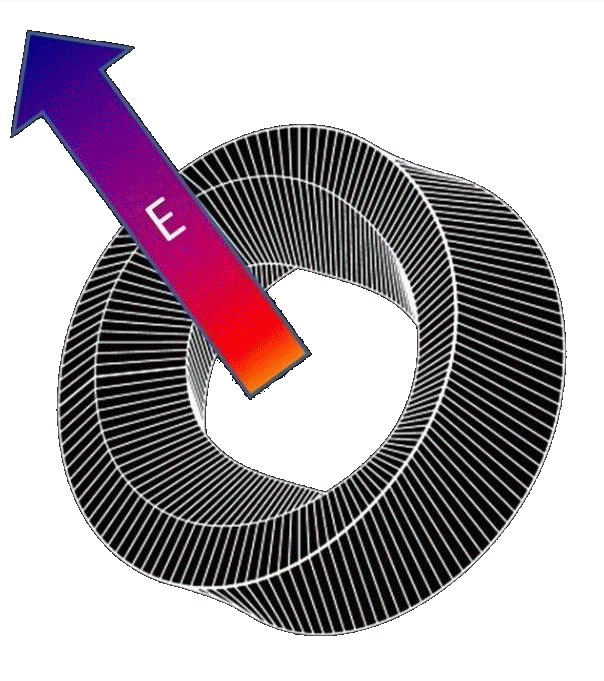
1° une polarisation permanente, c'est-à-dire un champ électrique permanent, (comme un aimant garde un champ magnétique permanent).

2° ET, être constitué d'un matériau plastique, comme le sont les protéines …
/image%2F2354072%2F20230703%2Fob_d380f1_hysteresis-schema-sans-legende-04.jpg)
Dans une courbe d’hystérésis, la valeur de la polarisation, D, est fonction du champ appliqué, E,
La polarisation D atteint une valeur maximum Ds et une autre valeur pour un champ électrique négatif.
La polarisation dépend aussi du sens dans lequel ce champ est appliqué ; sur le schéma, d’abord, en partant de Ds vers les valeurs négatives puis les valeurs positives
Quand le champ électrique extérieur croît, la polarisation ne suit pas la première courbe.
Quand E redevient nul, la polarisation ne revient pas à sa valeur initiale mais à une polarisation Dr. « r » pour rémanente ou résiduelle, c'est-à-dire une polarisation qui est conservée après la disparition du champ extérieur.
La polarisation peut être annulée quand la protéine est soumise à un champ électrique Ec
Il est remarquable :
- qu’une polarisation nulle peut être atteinte par deux valeurs différentes du champ électrique extérieur.
- que deux polarisations rémanentes Dr soient obtenues, une Dr+ pour une polarisation positive et une autre Dr-, pour une polarisation négative
Chaque valeur de la polarisation correspond aussi à une structure spatiale différente de la protéine.

En considérant, la structure de la protéine, Dr correspond à la forme donnée à l’argile par le potier quand celui-ci a fini son travail, ou au chewing-gum quand le mâchonnement a cessé.
/image%2F2354072%2F20230618%2Fob_585f07_hysteresis-elastine.jpg)
La ferroélectricité de l’élastine (protéine qui confère son élasticité au derme, aux vaisseaux sanguins, aux ligaments, à certains tendons, …), étudiée par l’équipe de Jiangyu Li de l’Université de Washington (Seattle, USA) en 2014 est une exception qui justifie que ces travaux soit regardés avec le plus grand intérêt
/image%2F2354072%2F20230702%2Fob_0782e7_hysteresis-schema-sans-legende-04.jpg)
Remarque : Les courbes ci-contre correspondent à la première partie descendante des courbes « inversées » du cycle d'hystérésis de la figure ci-dessus
Soumise à un champ électrique extérieur, les charges électriques d'une protéine subissent une modification spatiale,
... qui provoque un changement de conformation de la protéine,
... qui lui-même confère un changement du vecteur de champ électrique associé, de son dipôle électrostatique, de sa polarisation, ....
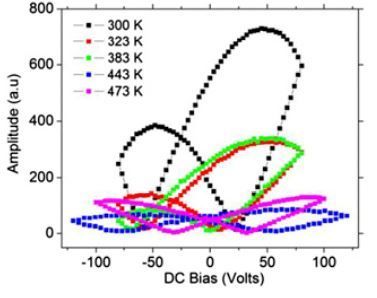
L’enregistrement de l’amplitude de cette déformation (courbe ci-contre) donne une « courbe en papillon ».
Jiangyu Li de l’Université de Washington (Seattle, USA) nous donne des exemples pour l’élastine (à différentes températures). Voir Notre mémoire ferroélectrique.
On remarque la très grande amplitude des déformations de l'élastine à 27°C (300°K) - courbe noire.
DC Bias = 0 volts, correspond à la polarisation résiduelle Dr de la courbe d’hystérésis, et l'amplitude des déformations qui, (propriété remarquable pour la "mémoire") différent en fonction du sens selon lequel la courbe d'hystérésis est parcourue !
L’absence (annulation) de polarisation (Ec) de l’élastine (à 300°K, courbe noire) s’observe pour environ deux champs électriques extérieurs : -60 Volts et + 25 Volts.
Deux causes pour un même effet !
À ma connaissance, aucune étude biophysique approfondie de cette très étonnante courbe en papillon des protéines n’a encore été réalisée.
La piézoélectricité et la pyroélectricité de l’élastine ont également été étudiées par l’équipe de Jiangyu Li .Voir Piézoélectricité des protéines

On peut voir à l’occasion de la pyroélectricité la grande différence de comportement entre deux protéines, l’élastine en rouge, le collagène en vert (« collogen » par erreur sur la figure, pour "collagen") une protéine de structure comme l’élastine)
Dans l'exemple ci-dessous une protéine client est repliée "convenablement" par HSP70
/image%2F2354072%2F20230604%2Fob_c4ca7a_hsp.jpg)
/image%2F2354072%2F20230604%2Fob_78f0c2_hsp-vecteur.jpg)
Lors de cette catalyse, la protéine client est placée au centre du tore.
Or, c’est aussi l’endroit de la protéine chaperon (HSP) où il y a le moins de « matière », mais tout porte à croire ...
... que c’est là, en centre, qu’est placé le vecteur ferroélectrique de la HSP ...
... et que le vecteur des protéines de stress est particulièrement puissant.
/image%2F2354072%2F20230604%2Fob_ccea96_papillon.jpg)
Comme dans la figure en « papillon », le vecteur ferroélectrique de la protéine chaperon
- jouerait le rôle du champ électrique extérieur (DC Bias),
- provoquerait une déformation de la protéine client
- qui conduirait au repliement de la protéine client sous sa forme active ("native", dans la même conformation qu'à sa sortie du Réticulum endoplasmique)
/image%2F2354072%2F20230604%2Fob_c4ca7a_hsp.jpg)
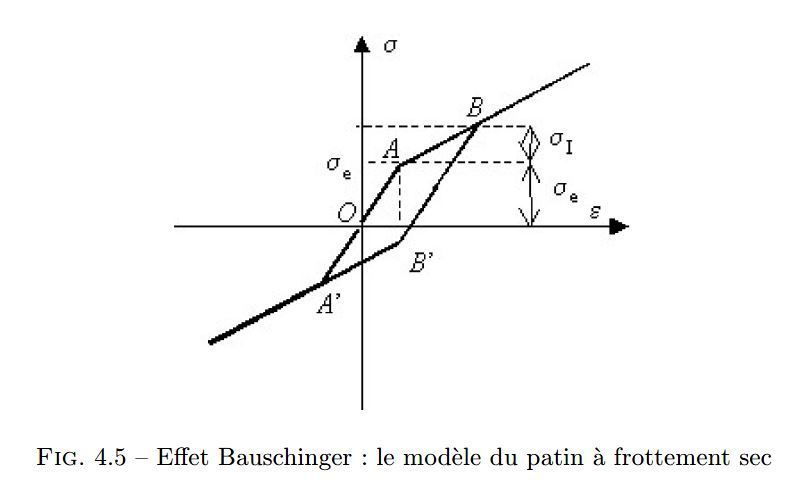
Il est intéressant de comparer l’effet Bauschinger, du chapitre plasticité du cours de Mécanique du solide et des matériaux de Jean-Claude Charmet.
… ou « effet du patin à frottement sec »

Comme quand on pousse une lourde caisse sur un sol rugueux, il faut un minimum de poussée pour que la caisse commence à bouger, c'est-à-dire qu’il faut dépasser le seuil d’un « frottement solide » A, semblable à un « patin sec ». Ensuite, une fois la caisse en mouvement, une poussée plus faible suffit à la déplacer, segment AB -.
Dans une protéine, il faut un minimum d’énergie, un minimum de champ électrique, pour commencer à faire bouger les atomes (ayant une certaine liberté de mouvement), c’est la partie montante de la courbe d'hystérésis, ensuite ils se déplacent facilement, c’est la partie moins pentue, presque horizontale.
Bibliographie
Quelques études systématiques sur les propriétés ferroélectriques des protéines ont été publiées dans les années … 1950, et semblent presque avoir été complètement abandonnées depuis !

- Quand chercheur (très) débutant, je fus reçu par Jacques Monod dans son bureau de l’Institut Pasteur et que je lui exprimais mon intérêt de biophysicien pour la ferroélectricité des protéines, le Prix Nobel me demanda avec beaucoup de civilité si un autre sujet m’intéressait.
- Ma connaissance de la ferroélectricité des protéines, je l’avoue, est restée conceptuelle.

L' étude sur la ferroélectricité de l’élastine demeure une exception que je détaille dans
03. Notre mémoire ferroélectrique.

/image%2F2354072%2F20230622%2Fob_525fa9_english-flag.jpg)