La biologie vectorisée ?
/image%2F2354072%2F20230702%2Fob_0fb3a8_biologie-vecteurs-02-converture.jpg)
Chaque vecteur associé à une protéine permettrait-il de modéliser le métabolisme biologique ? Comme la protéine, ce vecteur serait plastique, hystérétique, électrodéformables, dynamique (avec « mémoire ») et probabiliste.
Pourrions nous réduire le concept structure-fonction des protéines à celui de vecteur-fonction.
1° Considérons le métabolisme comme un ensemble (complexe) de relations entre des protéines, et des champs électriques (j’ajouterais volontiers, et le hasard).
2° Chaque protéine peut maintenant être représentée, in silico, par son vecteur (dipôle électrique) qui lui est associé.
Par exemple la TAQ RNA polymerase recensée par le serveur du Weizmann Institute of Science,
(les TAQ polymérases sont utilisées pour l'amplification dans la PCR, polymerase chain reaction).
/image%2F2354072%2F20230617%2Fob_4a8ce0_taq-polymerase.jpg)
Le métabolisme pourrait-il être résolu par des calculs vectoriels ? Au moins de s’en rapprocher, à condition d’ajouter d’autres paramètres :
4° L’association de ces deux propriétés, dipôle électrique et plasticité, confère aux protéines des propriétés hystérétiques (ou, par analogie, « ferroélectrique »)
/image%2F2354072%2F20230703%2Fob_bb93d8_hysteresis-schema-sans-legende-04.jpg)
(Hystérésis : Phénomène par lequel la polarisation D d'une substance soumise à un champ électrique E dépend, non seulement de l'intensité actuelle de ce champ, mais aussi de ses valeurs antérieures
selon une courbe d’hystérésis dont un exemple est reporté ci-contre
Une protéine porte donc en elle une « mémoire » hystérétique Dr en absence de champ électrique extérieur E
/image%2F2354072%2F20230702%2Fob_d793c4_shannon.jpg)
Plus généralement chaque état entropique d’une protéine porte une « information », au sens donné par Claude Shannon.
5° Les protéines sont, plus ou moins, « électrodéformable » ...
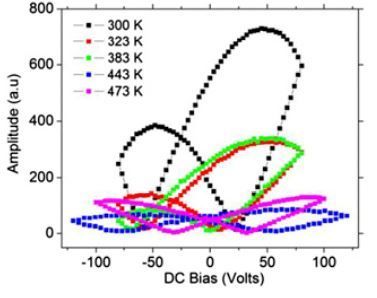
... c’est-à-dire que leur structure est déformable sous l’action d’un champ électrique extérieur E.
Le vecteur associé à la protéine est donc électrodéformable.
Dans l’exemple d’une protéine chaperon (HSP 70), ….
/image%2F2354072%2F20230604%2Fob_c4ca7a_hsp.jpg)
/image%2F2354072%2F20230705%2Fob_e1ac44_client-hyster.jpg)
… imaginons que la polarisation intrinsèque de la protéine client dépliée soit Du, sous l’action du champ électrique de la protéine chaperon, la polarisation de la protéine client devient Ds.
Une fois que la protéine chaperon se retire, le champ électrique de la protéine client ne revient pas 0, mais à une valeur Df correspond à la protéine convenablement repliée.
Le champ électrique extérieur auquel est soumis la protéine A peut être celui d’une protéine voisine B (ou d’un ensemble de protéines et de champs électriques.)
Réciproquement cette protéine voisine B est aussi le champ électrique extérieur de la protéine A, et déforme le vecteur de la protéine A (ou d’un ensemble de protéines et de champs électriques, Voir Notre mémoire revisitée).
Les protéines, ainsi que leur vecteur associé, pourraient être mieux définies comme étant plastiques, hystérétique, et électrodéformables »
D’autres facteurs sont à prendre en considération :
6° Dans le métabolisme, une protéine n’est jamais seule. Tout l’environnement concoure à modifier la structure de la protéine (et son vecteur associé).
Par exemple :
/image%2F2354072%2F20230704%2Fob_4fac3e_disso-agre.jpg)
- L’état entropique de l’eau disponible, « en vrac » ou « comme de la glace » conditionne ces environnements notamment la dissolution/agrégation des protéines, etc.
- Pour les enzymes, il faut ajouter l’environnement apporté par le substrat et les effecteurs (allostériques ou autres),
- Les ions (calcium, …),
- etc.
La vie étant un système dynamique, ces calculs vectoriels deviendront encore plus complexes.
/image%2F2354072%2F20231020%2Fob_7c1f0b_cheret-la-danse.jpg)
7° Aux températures de la vie, la plasticité « entropique » permet aux protéines de changer continuellement, et naturellement, de conformation. La structure des protéines est dynamique.
Les protéines les plus intrinsèquement désordonnées « gigotent » davantage que les autres. C’est ce que certains auteurs nomment « la danse des protéines », quoique « danser » sous-entend de suivre chorégraphie bien établie, or il semble les mouvements des protéines soient, au moins en partie, aléatoires, voir 8° ci-dessous
Il est donc nécessaire de passer à d’un espace 3D à un espace à 4D, … et même davantage en tenant compte de la conformation passée, c'est à dire la mémoire hystérétique.
Les protéines, ainsi que leur vecteur associé, pourraient être définies comme étant plastiques, hystérétiques, électrodéformables et dynamiques (avec « mémoire ».
8° Toutes les conformations possibles de la protéine, et de son vecteur, ne sont pas toutes aussi probables.
L’activité catalytique d’une protéine-enzyme n’est possible que quand elle est dans une certaine conformation, et cet état thermodynamique n’est pas nécessairement la plus probable !
/image%2F2354072%2F20230702%2Fob_66aba8_chat.jpg)
A ces probabilités, il conviendrait d’ajouter le pur hasard.
/image%2F2354072%2F20231020%2Fob_ff6306_vanite-marrell1637-karlsruhe-tout-per.jpg)
9° Les vecteurs de la vie sont constamment renouvelés, sinon la vie elle-même s’arrête !
(elle est rattrapée par le 2ème principe de la thermodynamique)
De leur côté, les données produites par les ordinateurs sont fixes et peuvent être gravés sur un support.
Finalement : les protéines, ainsi que leur vecteur associé, pourraient-elles être définies comme étant plastiques, hystérétiques, électrodéformables, dynamiques (avec « mémoire »), probabilistes et constamment renouvelés ?
Le calcul mathématique avec des vecteurs ayant de telles propriétés permettrait-il de mieux appréhender la biologie ?
Li-E Zheng et ses collègues nous invitent à passer de la (bio)chimie à la (bio)physique. Franchirions-nous une étape supplémentaire avec les (bio)mathématiques des vecteurs, … et autres tenseurs ?

/image%2F2354072%2F20230702%2Fob_6108b1_chewing-gum.jpg)
/image%2F2354072%2F20240423%2Fob_ba9d0f_ia-loi-google-01.jpg)
/image%2F2354072%2F20240416%2Fob_aecd5c_ia-meilleur-pire-mariage-02.jpg)
/image%2F2354072%2F20240401%2Fob_1a57ad_ia-surnaturel-chapelier-fou-mit-00.jpg)
/image%2F2354072%2F20240316%2Fob_3cdfa9_ia-chasseur-00.jpg)