Cheveux subitement blancs. De la ferroélectricité ?
/image%2F2354072%2F20230620%2Fob_0bcd3e_couverture-cheveu-01.jpg)
Comment un cheveu peut-il devenir subitement blanc, alors que le cheveu est un « tissu mort »?
La perte de la pigmentation serait-elle la conséquence d’une séries de phénomènes purement physiques ?
Les différentes étapes seraient les suivantes :
Le vecteur ferroélectrique de protéines de stress agit comme un puissant « champ électrique extérieur » sur les protéines (clientes) du mélanosome le plus proche.
Les modifications provoquées dans la structure des protéines du premier mélanosome …
1° … confère à celui-ci un nouveau vecteur ferroélectrique qui à son tour devient le « champ électrique extérieur » du mélanosome voisin,
2° … (puis) déstabilisent la structure des protéines du premier mélanosome puis du suivant, etc.
De proche en proche les protéines de tous les mélanosomes perdent leur cohésion.
Dans chaque mélanosome, l’organisation de la structure des protéines sur lesquelles étaient fixée la mélanine disparaît et la pigmentation disparaît également, physiquement, de proche en proche, tout au long du cheveu,
/image%2F2354072%2F20230622%2Fob_937ccf_dominos-03.jpg)
... comme des dominos tombent les uns après les autres !

/image%2F2354072%2F20230619%2Fob_f7f3df_notre-memoire.jpg)
En filigrane, cet article est destiné à sensibiliser le lecteur sur l’importance de la ferroélectricité des protéines, ou des protéines « électrodéformables », ici pour le cheveu mais aussi pour notre mémoire revisitée.
Pour des raisons inconnues, …
« For unknow reasons, » c’est par ces mots, que commence le magistral article sur l’origine des cheveux blancs (paru dans Nature en avril 2023).
Mais, les auteurs ne résolvent qu'une partie du mystère, celui de la « pousse » (phase anagène*) des cheveux blancs à partir du bulbe pilaire, pas celui des cheveux qui, à la suite d'un stress puissant, deviennent subitement blancs sur toute leur longueur.
/image%2F2354072%2F20230610%2Fob_8b1c2e_phases.jpg)
* La période durant laquelle le cheveu pousse, est appelée phase anagène. Elle dure de 1 an à 3 ou 4 ans. Durant cette phase, le bulbe pilaire situé à l'extrémité inférieure du follicule se régénère puis produit la fibre capillaire. Le cheveu pousse ainsi d'environ 1 cm par mois.
Les autres phases du cycle pilaire sont : Phase catagène ou phase de repos et Phase télogène ou phase d'expulsion du cheveu.
Pour des compléments voir la chevelure et le cheveu comme substrats des shampooings
/image%2F2354072%2F20230526%2Fob_f25331_marie-antoinette.jpg)
Or, ce blanchiment total et instantané a été observé depuis toujours chez des (rares) personnes ayant subi un stress violent.
Il est quelquefois nommé « syndrome de Marie-Antoinette » en référence à la malheureuse reine de France dont tous les cheveux devinrent blancs pendant la nuit qui a suivi la lecture de sa condamnation à la peine de mort.
Plusieurs observations de ce syndrome à travers l’Histoire, se retrouvent dans l’article d’Alexander Navarini et Stephan Nobbe
De leur côté, Ahmetcan Kurt, Fehmi Balandi et Oytun Erbas,montrent que le stress émotionnel est la principale cause de ce syndrome.
Pour des raisons inconnues, ...
Faute de comprendre le mécanisme de ce blanchiment, certains auteurs (et non des moindres !) n’hésitent à assimiler ce syndrome à des « contes de fées » !
/image%2F2354072%2F20230612%2Fob_5644c2_contes-de-fees-ferro.jpg)
… sachant que les contes sont particulièrement agréables à l’esprit néoténique d’Homo sapiens
Il est vrai que
le cheveu étant un « tissu mort », comment peut-il devenir subitement blanc ?
Dans un "tissu mort", aucune réaction biochimique ne peut s’y produire spontanément.
/image%2F2354072%2F20230610%2Fob_261ae8_fee-electricite-dans-l-esprit-mucha.jpg)
Pour rester dans le domaine des « contes de fées », serait-ce une « fée physicienne » qui provoquerait ce blanchiment.
Et parmi les fées physiciennes, nous allons faire appel à une « fée ferroélectrique », sœur de la fée électricité des années 1900.
Fée électricité « dans l’esprit de Mucha »
Dans cette allégorie, un (seul) sein dénudé symbolise la Liberté apportée par l’électricité.
Dans cet article la Liberté sera de celle de faire des hypothèses audacieuses !
/image%2F2354072%2F20230612%2Fob_479ec4_fee-vecteur.jpg)
En remplaçant le fer de la pique tenue par la « fée » par un vecteur ferroélectrique cette arme serait-il la « baguette magique » utilisée par la Fée ferroélectrique pour faire blanchir totalement et instantané le cheveu, de certains individus soumis à un brutal stress ?
/image%2F2354072%2F20230610%2Fob_516ece_figures.jpg)
Once upon the time ... Imaginons qu’un stress puissant provoque une activité accrue de protéines de stress
/image%2F2354072%2F20230610%2Fob_d477ed_fig-1.jpg)
Au niveau du bulbe pilaire, le vecteur de ces protéines (HSP) devient le « champ électrique extérieur » des protéines du mélanosome voisin.
La mélanine est fixée sur les protéines du mélanosomes, l'ensemble formant un pigment conférant la couleur brune au cheveu
Figure 1
/image%2F2354072%2F20230613%2Fob_50d51d_fee-vecteur.jpg)
/image%2F2354072%2F20230610%2Fob_1d6454_figure-3.jpg)
Ce "champ électrique extérieur" provoque une modification/déformation de la structure protéique de ce mélanosome ...
Figure 2
/image%2F2354072%2F20230613%2Fob_50d51d_fee-vecteur.jpg)
/image%2F2354072%2F20230706%2Fob_7c4611_hyster-melanosome-02.jpg)
… ainsi qu’une modification de son vecteur associé selon les propriétés hystérétiques des protéines.
Pour plus de détails, voir La biologie vectorisée
/image%2F2354072%2F20230610%2Fob_1e69f9_figure-3.jpg)
Deux phénomènes de natures physiques se produisent ensuite, Figure 3 :
/image%2F2354072%2F20230613%2Fob_50d51d_fee-vecteur.jpg)
Le nouveau vecteur associé à ce mélanosome ...
1° ... devient le « champ électrique extérieur » du mélanosome voisin, et lui fait subir le même sort.
2° ... modifie la configuration ionique des protéines de la structure du mélanosome. Leur maturation a été effectuée avec un excès de charges cationiques (pH acide). Ces protéines sont instables en absence de ces charges.
(préférentiellement une de ces protéines, OCA2, a été reconnue comme instable sous l’effet d’un stress).
La nouvelle structure protéique est instable, et le mélanosome perd sa cohésion.
/image%2F2354072%2F20230610%2Fob_2a39fd_figure-4.jpg)
Sans la structure des protéines de soutien des mélanosomes, la mélanine n'est plus fixée et ne forme plus aucun pigment (voir § Pigments versus colorants).
Figure 4
/image%2F2354072%2F20230620%2Fob_a0205b_dominos-03.jpg)
De proche en proche (comme des dominos), ...
/image%2F2354072%2F20230619%2Fob_8262d6_decoloration-cheveux.jpg)
... la pigmentation disparait
et le cheveu devient entièrement blanc.
/image%2F2354072%2F20230611%2Fob_78c8e7_melanosome-serres.jpg)
Remarque : pour que le changement de vecteur modifie celui du voisin, il est nécessaire que les mélanosomes soient jointifs, ce qui est le cas, en effet :
1° Exclus des formes kératiniques très organisées des hélices et des écailles, les mélanosomes sont regroupés dans la kératine amorphe du cheveu
2° Si les pigments mélanosomes n’étaient pas serrés l’un contre l’autre, ils ne donneraient pas la couleur brune au cheveu !
/image%2F2354072%2F20230613%2Fob_50d51d_fee-vecteur.jpg)
Il m’est difficile d’imaginer une procédure expérimentale montrant le mode d’action de la Fée ferroélectrique sur le cheveu !
/image%2F2354072%2F20230613%2Fob_218e60_condensateur-3.jpg)
Peut-être en plaçant un cheveu brun dans un champ électrique puissant, comme celui qui se forme entre les deux plaques d’un condensateur. Mais le syndrome de Marie-Antoinette ne concerne que trop peu d’individus pouvant fournir des cheveux susceptibles de devenir brutalement blancs !
/image%2F2354072%2F20230613%2Fob_1ac55c_zymvol.jpg)
Plus sûrement, par des simulations in silico comme celles proposées par Zymvol, ... qui tient compte de la dynamique des protéines
/image%2F2354072%2F20230622%2Fob_e237b8_zymvol-02.jpg)
... qui tient compte de la dynamique des protéines
/image%2F2354072%2F20230524%2Fob_bd57e0_cheveux-longse-devant-mariage-copi.jpg)
Il convient de savoir pourquoi/comment un cheveu nous apparait coloré, pour simplifier nous nous contenterons ici du cheveu brun (voir aussi le § Pigment versus colorant)
De nombreux travaux traitent des spécificités des cheveux blonds et roux.
La coloration (naturelle) des cheveux est apportée par des pigments, les mélanosomes, produits par des cellules spécialisées : les mélanocytes.
/image%2F2354072%2F20230608%2Fob_98efd1_papillla-bulb.jpg)
Dans le cheveu (coloré) les mélanocytes sont concentrés dans le bulbe pileux/pilaire (Hair bulb), plus précisément dans la matrice (Hair matrix cell), dont la partie papillaire (Dermal papilla) est alimentée par la circulation sanguine (uniquement artériel pour la phase anagène)
/image%2F2354072%2F20230529%2Fob_1a7ea3_dediff-bulbe-pileux.jpg)
Sur la photographie empruntée au récent article de l’équipe de Mayumi Ito (University Grossman School of Medicine, New York, NY, USA ), les mélanocytes apparaissent, en rouge, dans la matrice (Fig 1c)
Comparés aux mélanocytes de l’épiderme (voir § ci-dessous), ceux du bulbe pileux (d'un cheveu brun) sont,
- plus nombreux. Un mélanocyte pour cinq kératinocytes, quand ils ne sont que de un pour trente-six kératinocytes dans l’épiderme.
- leurs mélanosomes sont deux à quatre fois plus volumineux,
- leurs dendrites sont plus longues
- leur présence est sous le contrôle du cycle pilaire. Ils ne sont présents que pendant la phase anagène (pousse).
/image%2F2354072%2F20230529%2Fob_6deb14_dediff-bulbe-pileux-poil-blanc.jpg)
Comme l’a montré magistralement la même équipe, les mélanocytes ne sont pas présents dans la papille des bulbes pilaires des cheveux qui poussent blancs (phase anagène). Fig 4e
/image%2F2354072%2F20230616%2Fob_baf7af_marie-antoinette-guillotinee.jpg)
En raison de la vie dramatiquement écourtée* de Marie-Antoinette, après que ses cheveux soient devenus subitement blancs, il est difficile de dire si ses cheveux aurait continué de pousser blancs.
* Robespierre c’est hâté de faire prononcer la sentence et la faire l’exécuter, car Marie-Antoinette était mourante (cancer de l’utérus ?).
/image%2F2354072%2F20230616%2Fob_224732_arbre-foudroye.jpg)
D’après de rares témoignages, comme des cheveux devenant brutalement blanc chez des individus se trouvant sous un arbre frappé par la foudre, il semble que les cheveux devenues subitement blancs restent blancs pendant leur phase anagène.
Il est probable que le puissant stress ait également concerné la matrice du bulbe et que les mélanocytes ne se positionnent plus dans la papille. Voir ci-dessus Site de production des mélanosomes dans le cheveu.
/image%2F2354072%2F20230528%2Fob_75c097_maturation-de-melanosomes-dans-le-me.jpg)
Les mélanosomes, sont des organites cellulaires synthétisés par les mélanocytes.
Ils sont constituées de protéines fibreuses réticulées à l'intérieur desquels la mélanine est fixée.
Figure ci-contre empruntée à M Cichorek, M Wachulska, A Stasiewicz Heterogeneity of neural crest-derived melanocytes
Bien que cela n’apparaisse pas sur la figure, pendant leur synthèse, et tant qu'ils restent dans les mélanocytes, les mélanosomes sont placés contre à la membrane cellulaire.
/image%2F2354072%2F20230609%2Fob_9fe642_melanosome-stage-ii.jpg)
Les différents stades de maturation des mélanosomes sont visibles sur cette photographie (empruntée à John Mercier et al.)
Au stade II (flèche blanche), au début de la synthèse de mélanine, la structure protéique n’apparaît que très peu colorée.
/image%2F2354072%2F20230528%2Fob_2b1a7e_melanine.jpg)
La mélanine est un ensemble de polymères polycycliques, amorphes, plus ou moins bien définis.
Voir ci-contre la formule de l’eumélanine (celle des cheveux bruns) représentative de la mélanine considérée dans cet article.
/image%2F2354072%2F20230528%2Fob_5cbb64_melanine-synthese-dans-melanosome-h.jpg)
L'enzyme clé impliquée dans la synthèse de tous les types de mélanines est la tyrosinase (EC 1.14.18.1).
/image%2F2354072%2F20230528%2Fob_c57192_soleil-dopa-image1.jpg)
Le substrat de cette enzyme est un acide aminé : la tyrosine ; un intermédiaire important est la Dopamine (DOPA, que l'on retrouve également dans le cerveau)
La figure ci-jointe (empruntée à la review de Vincent J. Hearing) donne les différentes étapes de la synthèse de la (eu)mélanine.
/image%2F2354072%2F20230524%2Fob_a9c788_melanosynth.png)
Les mélanosomes matures (stade IV) sont ensuite « injectés », par les mélanocytes dans le cytosol des kératinocytes à l’aide de dendrites (prolongement « tentaculaire » de la membrane du mélanocyte, sur lesquels sont fixés les mélanosomes).
Le mélanocyte est à droite de la figure ci-contre.
Du point de vue du kératinocyte, celui-ci phagocyte les mélanosomes.
Bien qu’à partir de cette étape, les mélanosomes soient « libres » dans le cytosol des kératinocytes, la mélanine y reste compartimentée, ce qui lui permet de former/rester un pigment.
/image%2F2354072%2F20230601%2Fob_cbb840_massimo-vitali.png)
Un petit détour par l’épiderme va nous permettre de mieux appréhender l’importance des pigments dans l’apparence brune, « bronzée », donnée par la peau dont le phototype correspond à Celle/Celui-qui-veut-bronzer (et qui peut bronzer !). Voir La beauté au soleil
Stimulés par un bain de soleil, les mélanocytes épidermique, une fois « réveillés », ravitaillent les kératinocytes en pigments protecteurs (et esthétiques selon l’objectif de Celle/Celui-qui-veut-bronzer, et qui peut bronzer)
/image%2F2354072%2F20230602%2Fob_ca1c4d_piderme.jpg)
Pour les kératinocytes, les mélanosomes sont considérés comme des « corps étrangers ». Ils utilisent leurs protéases pour les éliminer, avec plus ou moins de succès selon les individus (voir photo-types, dans La beauté au soleil, la théorie).
Dans l’épiderme de Celle/Celui-qui-veut-bronzer ..., la destruction progressive de la structure protéique des mélanosomes provoque une dépigmentation, également progressive.
/image%2F2354072%2F20230602%2Fob_5cbc43_piderme-depigmente.jpg)
Au fur et à mesure de la kératinisation de l'épiderme, et de la "montée" des kératinocytes ceux-ci contiennent de moins en moins de pigments. Au stade ultime de la kératinisation (stratum corneum) quand les kératinocytes sont devenus des cornéocytes et un « tissu mort » (comme le cheveu), ils sont dépigmentés, et apparaissent « blancs », comme le cheveu blanc.
Après avoir pris sa douche, Celle/Celui-qui-veut-bronzer … ne retrouve sur le pourtour du bac aucune trace grisâtre, contrairement à d’autres prototypes pour lesquels leurs mélanosomes sont très résistants aux protéases et persistent intacts jusque dans les cornéocytes.
L’éphémère du hâle de cet épiderme montre que sans protéine de support, la pigmentation disparaît, bien que la mélanine n’ait pas été modifiée (ou faiblement pas l’absorption de photons UV).
Sans protéine de support, pas de pigment
et sans pigment, pas de coloration apparente.
/image%2F2354072%2F20230612%2Fob_ece672_fee-vecteur.jpg)
Cet exemple de l’épiderme de Celle/Celui-qui-veut-bronzer (et qui peut bronzer !) a été utilisé pour l'hypothèse de la méthode utilisée par la « fée ferroélectrique » dans le syndrome de Marie-Antoinette.
Il montre aussi, à l'occasion, la grande variété de l’espèce Homo sapiens vis-à-vis des mélanosomes, variété qui peut s'étendre aux individus dont les cheveux sont devenus subitement blanc à la suite d'un stress
/image%2F2354072%2F20230602%2Fob_355a60_bulb-hair-03.jpg)
Dans le bulbe pilaire, où la maturation des kératinocytes vers un « tissu mort » est très rapide, l'hydrolyse des protéines est faible, le cheveu reste pigmenté (ou non pigmenté si les mélanocytes sont absents (voir § ci-dessus Site de production des mélanosomes)

La formation des mélanosomes concerne la mise en place des protéines (en réalité des glycoprotéines) de support et la synthèse des mélanines à l'intérieur de ce maillage.
Remarque : La protéine pré-mélanosomale (Pmel17) est une amyloïde fonctionnelle humaine.
/image%2F2354072%2F20230601%2Fob_3eeaae_astrocytes.jpg)
La peau et le cerveau ayant la même origine embryologique, il n’est pas vraiment surprenant de retrouver des protéines amyloïdes dans ces deux tissus.
De plus, avec leurs dendrites (qui permettent l'injection des mélanosomes), les mélanocytes ont un air de parenté avec les astrocytes (ci contre) du cerveau.
Des dysfonctionnements de la gestion des amyloïdes dans le cerveau sont impliqués dans différents troubles neuro-pathologiques comme la maladie d’Alzheimer. Quelques études portent sur ce parallèle : par exemple celle de Clay W. Scott (2016)
Selon les travaux de Jennifer C. Lee et ses collègues du Laboratory of Protein Conformation … National Institutes of Health, USA) La maturation de ces protéines [des mélanosomes] en différentes protéines fibreuses est dépendante du pH interne de l’organite en formation.
La maturation, des fibrilles appariées en forme de bâtonnet, ne se produit qu’à un pH ≤ 6.
Cette maturation passe par une « transition structurelle secondaire à partir d’un mixte formé d'un arrangement aléatoire (random coil) et de feuillet β ”. ...
/image%2F2354072%2F20230530%2Fob_a2dfc9_proteines-des-melanosomes-computatio.jpg)
... alors que les protéines « finales » (TPC2, ATP7A, SLC45A2 et OCA2) qui forment le maillage du mélanosome, sont principalement structurées en hélice alpha, comme le montre la Fig.2, ci-contre, … empruntée à Emil Alexov et ses collègues (Department of Dermatology, Weill Cornell Medical College, New York, USA)
Si un pH acide est nécessaire à la maturation des protéines, une fois, les protéines du mélanomes mises en place, au stade IV, le pH devient 7.
Ce pH « neutre » est favorable à l’activité catalytique de la tyrosinase (TYR sur la figure) donc la production de mélanine.
L’« acidité » interne des mélanosomes traduit la présence (dominante) de protons H+ et surtour reflète la présence des charges ioniques des protéines impliquées lors de cette maturation.
/image%2F2354072%2F20230601%2Fob_217cc8_his-protonation-03.jpg)
Remarque : La présence de l’histidine, indiquée également par Jennifer Lee et al. pourrait jouer un rôle primordial dans les modifications des charges ioniques des protéines entre un pH acide (inférieur à 6).
Le pKa des fonctions latérales histidyl est d’environ 6.
À un pH inférieur à cette valeur, le noyau imidazolium (en bleu) de l’histidyl est chargé positivement, à pH 7, il ne présente aucune charge.
/image%2F2354072%2F20230607%2Fob_69cee7_ph.jpg)
/image%2F2354072%2F20230612%2Fob_4a5308_fee-vecteur.jpg)
Point surprenant (féerique ?) : La maturation des protéines impliquées dans formation de la structure de l’organite-mélanosome (du stade I au stade III) se produit à un pH acide,
... c'est à dire avec une certaine répartition des charges cationiques (celles de l’histidyl) dans l’espace de chaque protéine,
.... c'est à dire que chaque protéine possède un certain vecteur ferro-électrique.
Ces protéines matures sont présumées stables à ce pH acide et avoir le vecteur associé aux charges ioniques correspondantes à ce pH.
Or, lors de la maturation finale (stade IV), le pH est 7, c'est à dire que les charges cationiques générées par l’histidyl ont disparu, le vecteur ferroélectrique de chaque protéine a été modifié.
L’ensemble de ces protéines fibreuses forment une organite-mélanosome stable mais, avec ce nouveau vecteur, chaque protéine n’est-elle pas dans une structure instable ?

Pour des rappels généraux sur les protéines, voir Notre mémoire… protéique, ... Annexes

Les protéines (dans l'eau ou un solvant hydrophile) présentent des charges positives et négatives
Voir Le chapitre sur les champs électriques générés par les protéines
/image%2F2354072%2F20230603%2Fob_a3b72f_elastine-charges-02.jpg)
Une fois la structure quaternaire formée, un certain nombre de charges persistent et sont réparties dans l'espace. Cette répartition diffère selon la nature de la protéine et sa conformation (qui, elle-même est variable en fonction de son état ionique, donc avec le "pH").
La figure ci-contre (empruntée à l’équipe de Jiangyu Li de l’Université de Washington; Seattle, USA) représente les charges ioniques d'une des conformations de la tropoélastine.
Plus la couleur est bleue, plus la charge est négative, plus la charge est rouge, plus elle est positive.
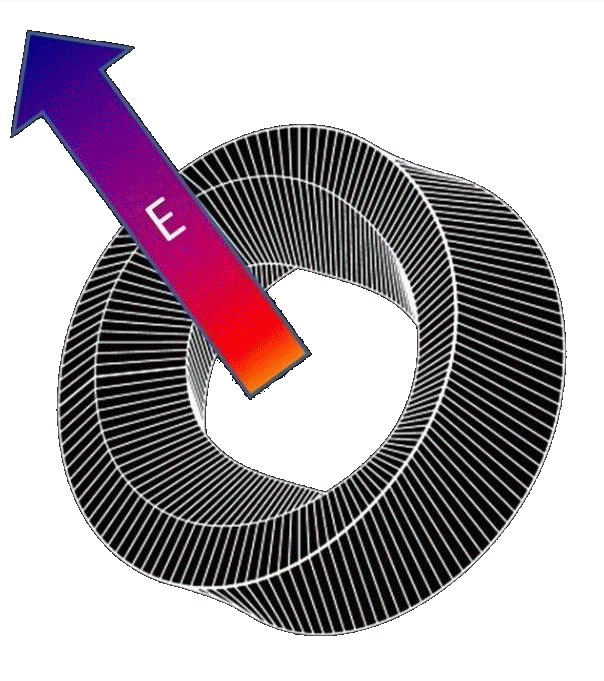
La non coïncidence des barycentres des charges positives et négatives des protéines forment un dipôle électrostatique équivalent et qui peut être représenté par un vecteur (flèche E ), ici dans l'exemple d'une protéine torique.
/image%2F2354072%2F20230607%2Fob_3c4d12_image1.gif)
Le vecteur est modifié selon la conformation de la protéine.
/image%2F2354072%2F20230604%2Fob_a5e1e3_eau-proteines.jpg)
Comparé à celui de la molécule d’eau, considéré pourtant comme « très » polaire (1,85 Debye), le champ électrique (moment dipolaire) associé aux protéines, comme ici l'élastine, peut être de plusieurs centaines de Debyes. … qui correspond à une valeur « moyenne » des moments dipolaires calculés in silico.
La valeur du moment dipolaire peut atteindre des valeurs beaucoup plus importantes...
/image%2F2354072%2F20230617%2Fob_bdda4b_septine.jpg)
... comme 2711 Debyes (POS sur la figure) pour un complexe de septines (protéines du groupe des GTP-binding proteins)
L’élastine est, à ma connaissance, la seule protéine dont le champ électrique ait été mesuré.
Par contre le dipôle de nombreuses protéines a été déterminé in silico, c'est à dire par des calculs informatiques, (http://bip.weizmann.ac.il/dipol) .
Par exemple fig 2 C pour la TAQ RNA polymerase, où le vecteur est représenté.
(les TAQ polymérases sont utilisées pour l'amplification dans la PCR, polymerase chain reaction).
/image%2F2354072%2F20230617%2Fob_4a8ce0_taq-polymerase.jpg)
ferroélectrique s’il possède :
(le préfixe "ferro" fait référence à une analogie, et non pas à la présence de fer ! Une dénomination comme électrodéformable serait-elle mieux acceptée ?)
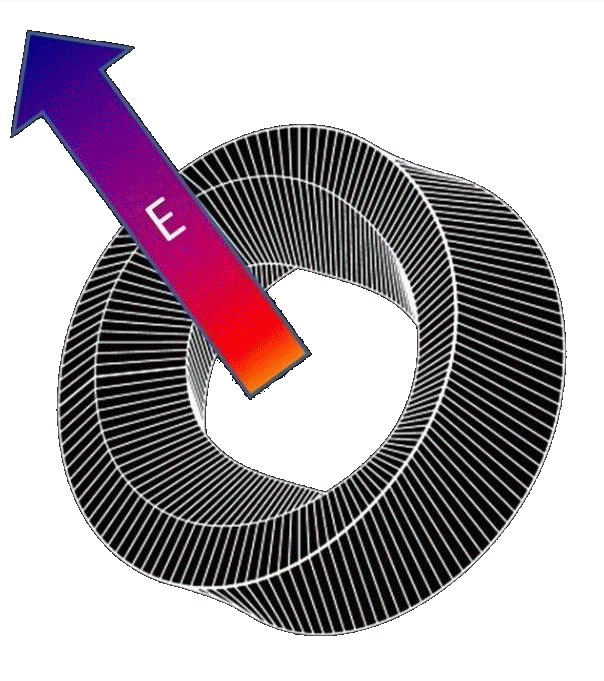
1° une polarisation permanente, c'est-à-dire un champ électrique permanent, (comme un aimant garde un champ magnétique permanent).

2° Si ce matériau est plastique, comme le sont les protéines …
... si on applique un champ électrique extérieur, la polarisation du matériau ferroélectrique est modifiée et une courbe d’hystérésis semblable à celle de la figure ci-dessous peut être observée.
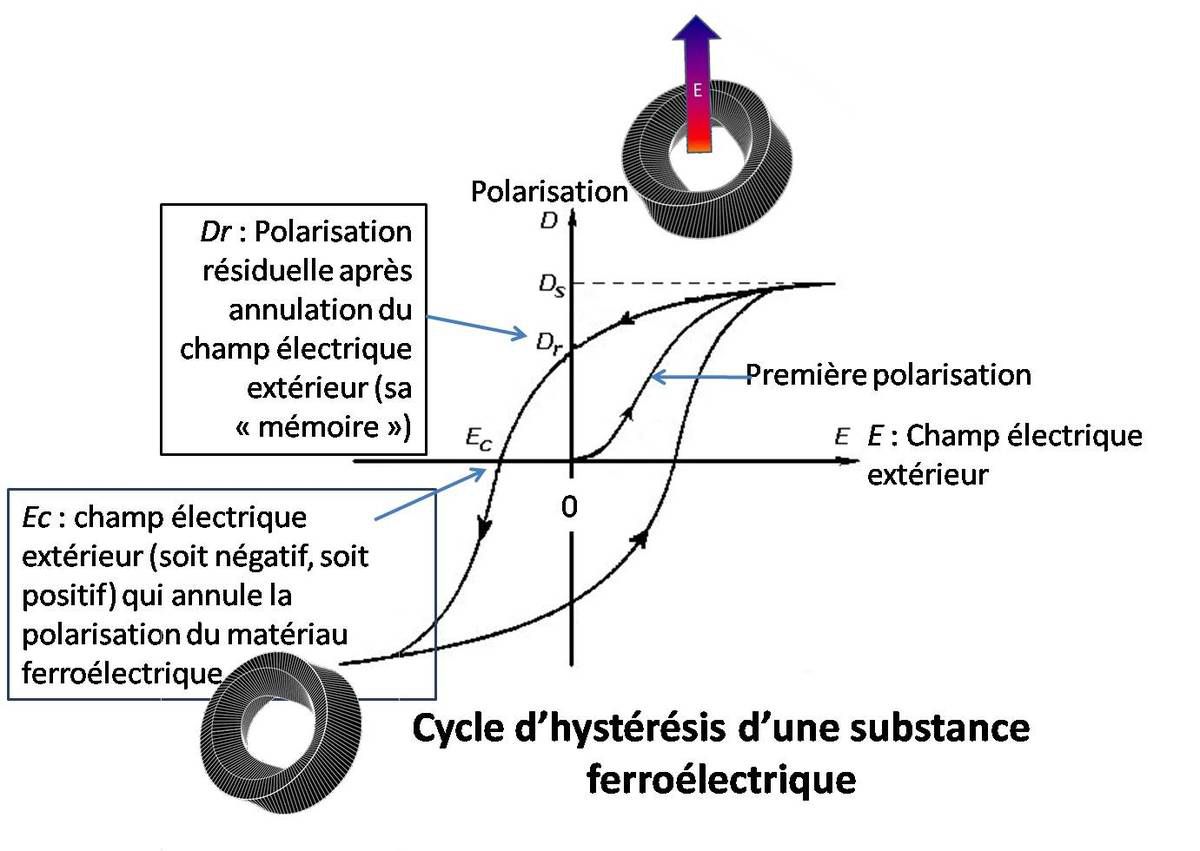
En annulant le champ électrique extérieur (E 0,0), la plasticité du matériau permet à celui-ci de conserver un champ électrique (polarisation) Dr ...
(« r » pour rémanente, c'est-à-dire qu'une polarisation Dr est conservée après la disparition du champ extérieur.)
... comme si le matériau ferroélectrique conservait une « mémoire » de son expérience passée. (voir Notre mémoire protéique et Notre mémoire revisitée)
Le vecteur de polarisation de la protéine peut être annulé par un champ électrique extérieur Ec
/image%2F2354072%2F20230609%2Fob_692acd_melanosomes-vecteur.jpg)
Le mélanosome étant formé d’un ensemble des protéines, un vecteur ferroélectrique lui est associé
... vecteur résultant de celui de chacune des protéines et de leurs interactions réciproques lors de la formation du mélanosome.
Déformation d’une protéine sous l’effet d’un champ électrique.

/image%2F2354072%2F20230530%2Fob_4aeecc_vecteur.jpg)
Le champ électrique généré par les charges d’une protéine n’est ni fixe ni rigide, il aussi plastique que l'est la protéine à laquelle il est associé.
La plasticité des protéines permet au vecteur champ électrique d’être modifié aussi bien dans sa position que son module.
(... et, réciproquement, aux protéines d'être ferroélectriques, voir 03. Notre mémoire ferroélectrique.)
La courbe d’hystérésis ci-dessus; rend compte des champs électriques, mais pas des déformations que subit le matériau ferroélectrique (donc plastique)
Soumise à un champ électrique extérieur, les charges électriques d'une protéine subissent une modification spatiale,
... qui provoque un changement de conformation de la protéine,
... qui lui-même confère un changement du vecteur de champ électrique associé, de son dipôle électrostatique, de sa polarisation, ....
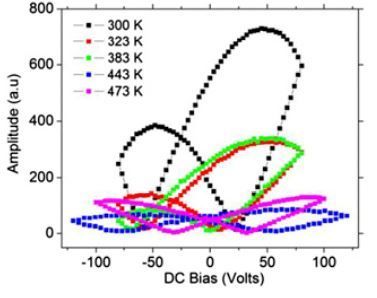
L’enregistrement de l’amplitude de cette déformation (courbe ci-contre) donne une « courbe en papillon ».
Jiangyu Li de l’Université de Washington (Seattle, USA) nous donne des exemples pour l’élastine (à différentes températures). Voir Notre mémoire ferroélectrique.
On remarque la très grande amplitude des déformations de l'élastine à 27°C (300°K) - courbe noire.
DC Bias = 0 volts, correspond à la polarisation résiduelle Dr de la courbe d’hystérésis, et l'amplitude des déformations qui, (propriété remarquable pour la "mémoire") différent en fonction du sens selon lequel la courbe d'hystérésis est parcourue !
/image%2F2354072%2F20230612%2Fob_168b6f_fee-vecteur.jpg)
L’absence (annulation) de polarisation (Ec) de l’élastine (à 300°K, courbe noire) s’observe pour environ deux champs électriques extérieurs : -60 Volts et + 25 Volts.
Deux causes pour un même effet !
À ma connaissance, aucune étude approfondie de biophysique sur cette très étonnante courbe en papillon des protéines n’a encore été réalisée.
/image%2F2354072%2F20230604%2Fob_a5e1e3_eau-proteines.jpg)
Comparé à celui de la molécule d’eau, considéré pourtant comme « très » polaire, le champ électrique (moment dipolaire) associé aux protéines, comme ici l'élastine, peut être de plusieurs centaines de Debyes.
/image%2F2354072%2F20230604%2Fob_082671_eau-molecule.jpg)
Celui de l’eau n’est que de 1,85 Debye
/image%2F2354072%2F20230612%2Fob_6c0b62_hsp-vecteur.jpg)
Aucune publication ne nous renseigne sur les vecteurs ferroélectriques des protéines des mélanosomes.
/image%2F2354072%2F20230530%2Fob_189cae_proteines-comparaison-avec-elastine.jpg)
Mais nous pouvons observer une certaine analogie structurale avec une autre protéine fibreuse : la (tropo)élastine
(représentée ici selon la publication d’Antonio Mario Tamburro, Antonietta Pepe et Brigida Bochicchio), et dont les propriétés ferroélectriques viennent d'être exposées.
Comme toutes les protéines fibreuses, les protéines du mélanosome contiennent de nombreuses structure en hélices alpha (rappel, après la restructuration à pH acide)
/image%2F2354072%2F20230604%2Fob_04ea1d_marie-antoinette-tete.jpg)
Le blanchiment total et instantané ayant été observé chez des personnes ayant subi un stress …
… il est légitime de s’intéresser aux protéines de stress, les HSP (Heat shock proteins) également nommées protéines chaperon en référence à leur principal mode d’action, replacer une protéine client dans une configuration active.
Dans l'exemple ci-dessous une protéine client est repliée "convenablement" par HSP70
/image%2F2354072%2F20230604%2Fob_c4ca7a_hsp.jpg)
/image%2F2354072%2F20230604%2Fob_78f0c2_hsp-vecteur.jpg)
Lors de cette catalyse, la protéine client est placée au centre du tore.
Or, c’est aussi l’endroit de la protéine chaperon (HSP) où il y a le moins de « matière », mais tout porte à croire ...
... que c’est là, en centre, qu’est placé le vecteur ferroélectrique de la HSP ...
... et que le vecteur des protéines de stress est particulièrement puissant.
/image%2F2354072%2F20230604%2Fob_ccea96_papillon.jpg)
Comme dans la figure en « papillon », le vecteur ferroélectrique de la protéine chaperon
- jouerait le rôle du champ électrique extérieur (DC Bias),
- provoquerait une déformation de la protéine client
- qui conduirait au repliement de la protéine client sous sa forme active ("native", dans la même conformation qu'à sa sortie du Réticulum endoplasmique)
/image%2F2354072%2F20230604%2Fob_c4ca7a_hsp.jpg)
/image%2F2354072%2F20230608%2Fob_c3470b_hsp-70-60.jpg)
Deux puissantes protéines chaperon, HSP70 et HSP60 sont présentes dans les kératinocytes (cytosol).
(voir Hair cycle-dependent expression of heat shock proteins in hair follicle epithelium)
Plus précisément, selon les auteurs, ces deux HSP sont situées, dans les kératinocytes, au niveau du renflement et la partie épithéliale du follicule pileux.
/image%2F2354072%2F20230608%2Fob_d41009_hsp-bulb-marie.jpg)
La photographie, empruntée à Wieslawa Widlak et ses collègues ...
/image%2F2354072%2F20230608%2Fob_4946d4_marie-curie-detail.jpg)
(Department of Tumor Biology du Maria Sklodowska-Curie Memorial, Gliwice, Poland),
... indique la présence de la protéine de stress HSP70 dans le bulbe pilaire, de vibrisses de souris. (Figure 10, a et b)
/image%2F2354072%2F20230604%2Fob_04ea1d_marie-antoinette-tete.jpg)
Les HSP sont présents au cours de la phase anagène (pousse du cheveu) et pendant la phase catagène (arrêt de la pousse), c'est à dire quand les cheveux sont bien présents et susceptibles de blanchir sous l’effet d’un stress brutal.
(L'expression des HSP est absente des follicules en phase télogène, perte du cheveu).
/image%2F2354072%2F20230609%2Fob_5c02c6_oca2.jpg)
Parmi les quatre protéines formant l’architecture fibreuse des mélanosomes (voir § ci-dessus sur les protéines), Prashiela Manga et son équipe ont montré que OCA2 est particulièrement sensible au stress.
Dans le mélanocyte, il est probable que le dépliement de la protéine OCA2 est réparée (par les HSP - protéines chaperon ?) et l'homéostasie est rétablie.
Dans le cheveu, qui est un « tissu mort », cette réparation ne peut évidemment pas être effectuée.
/image%2F2354072%2F20230609%2Fob_da9123_rer.jpg)
De plus, selon Prashiela Manga cette perturbation de la protéine OCA2 provoque une résistance accrue au stress du réticulum endoplasmique « rugueux » RER (« l’usine à protéines »), ... du mélanocyte.
/image%2F2354072%2F20230612%2Fob_168b6f_fee-vecteur.jpg)
Le réticulum endoplasmique garde ainsi la "mémoire" du stress qu'il a précédemment subi !.
/image%2F2354072%2F20230528%2Fob_bb67f5_cheveu-keratine-amorphe.jpg)
Le processus de kératinisation du cheveu aboutissant à des éléments très structurés comme les hélices et les écailles, les mélanosomes se retrouvent localisés dans la kératine amorphe, c'est à dire une protéine peu structurée (random coil) ...
... constituant la "Matrix" sur le schéma ci-dessous
/image%2F2354072%2F20230611%2Fob_50dd28_hair-melanosomes.jpg)
Schéma emprunté à Qiang Wang et Kee Woei Ng
/image%2F2354072%2F20230529%2Fob_4cdafd_pointe-fourchue.jpg)
La disparition de cette kératine amorphe provoque les « pointes fourchues » des cheveux endommagés.
/image%2F2354072%2F20230612%2Fob_168b6f_fee-vecteur.jpg)
Les mélanosomes étant des pigments, et non pas des colorants, avant de convoquer la Fée ferroélectrique, il aurait fallu connaître les nuances entre un pigment et un colorant.
Commençons par le plus simple, les colorants.
Les colorants qui sont des molécules en solution. Leur effet optique est conféré par la transmission d’une partie de la lumière blanche, l'autre partie est absorbée par les molécules. Celles-ci peuvent, suite à cette absorption, simplement s'agiter (effet thermique), être modifiée chimiquement, ou émettre un nouveau photon, ....
Les pigments sont formés par de fines particules.
Même si les pigments sont, au moins, mille fois plus grands qu’une molécule de colorant, ce n’est pas seulement une question de taille mais de mode d’action :
/image%2F2354072%2F20230528%2Fob_c9f639_spectrelum.jpeg)
L’effet optique des pigments est conféré par la réflexion, totale ou partielle, de la lumière ...
/image%2F2354072%2F20230529%2Fob_69f097_arcenciel.jpg)
... blanche qui est un mélange « dynamique » de toutes les couleurs visibles par l’œil humain,
celle de l’arc-en-ciel.
/image%2F2354072%2F20230528%2Fob_76c687_chlorophyle.jpg)
Dans l’exemple du pigment chlorophyllien, celui-ci absorbe (et utilise pour la photosynthèse) principalement la lumière rouge.
Une feuille nous apparaît verte.
Ce vert est, pour l’œil humain la « couleur complémentaire » du rouge.
En opto-physique il s'agit de tout le « reste (dynamique) » de la lumière blanche une fois le rouge ôté.
Contrairement à ce qui est écrit dans Wikipédia, ou même par Société Chimique de France !
… la mélanine, en solution, ne constitue pas un pigment, mais est juste un polymère colorant (un peu jaunâtre).
/image%2F2354072%2F20230613%2Fob_50f139_melanosome-stage-iv-photo.jpg)
Fixée sur les protéines d'une structure "en grain" comme celle des mélanosomes, la mélanine permet de former des pigments.
/image%2F2354072%2F20230528%2Fob_849932_iris-yeux-02.jpg)
La même mélanine, placée dans une structure « en peigne » permet une diffraction des couleurs, par exemple celles qui donne son aspect aux plumes de pigeon, ou à l’iris des yeux.
/image%2F2354072%2F20230529%2Fob_15bb2b_noir-pour-la-science-masques.jpg)
Un pigment est parfaitement noir s’il absorbe la totalité de la lumière.
Stricto sensu, un « colorant noir » devrait ne transmettre aucune lumière !
Par contre, en se fixant sur une structure, par exemple protéique, comme celle des mélanosomes ou de la laine, un « colorant noir » forme des pigments qui absorbent la lumière blanche.
/image%2F2354072%2F20230528%2Fob_195212_noir-pour-la-science.jpg)
Dans l'article « Du noir presque parfait », les auteurs montrent que pour qu’un objet apparaisse complétement noir, c'est à dire absorbe toute la lumière incidente, sa surface doit être structurée à l’échelle micrométrique ou nanométrique de façon qu’aucun rayon lumineux ne puisse « s’échapper ».
/image%2F2354072%2F20230611%2Fob_7de898_melanosome-stage-iv-photo.jpg)
À l’échelle de la pigmentation du cheveu, chaque mélanosome pourrait-il être une de ces pointes ?
/image%2F2354072%2F20230611%2Fob_ee92e2_melano-surface-rugueuse.jpg)
De plus, Shuuichi Akazaki et al. ont montré que la surface des mélanosomes (de souris) n’est pas lisse, mais rugueuse, ce qui renforce la « puissance » absorbance de la lumière blanche.
Comme le savent parfaitement les peintres, la couleur "rendue" (c'est à dire accessible à l’œil humain) est fonction de la dimension des pigments.
Si les dimensions du pigment sont insuffisantes, la lumière n’est plus assez « arrêtée/absorbée », et « l’objet » contenant cette « poussière » devient « invisible ». S'il est trop grand, ce n'est plus un pigment, mais un écran.
/image%2F2354072%2F20230529%2Fob_7ea6b7_melanosomes-taille.jpg)
La taille des mélanosomes humains est environ de 1 (µm2) x 10-2, avec de larges variations selon les cheveux des individus considérés.
Soit environ un « diamètre » moyen d’une centaine de nanomètres. Ce qui classe les mélanosomes parmi les pigments noirs plutôt grands.
/image%2F2354072%2F20230611%2Fob_17e331_cheveux-poivre-et-sel.jpg)
La puissance d’un pigment noir réside aussi dans l’homogénéité de ses pigments/particules. Ce qui est le cas des mélanosomes des cheveux d’un même individu.
Trop hétérogènes, les pigments noirs pourraient donner une apparence grise...
... Comme le mélange de cheveux blancs et de cheveux noirs, chez un même personne, donne des cheveux gris ou "poivre et sel"
La proximité entre les pigments est également un facteur d’efficacité, s’ils sont trop éloignés les uns de autres, la lumière parvient à « s’échapper » entre les particules.
Les peintres savent que les pigments ne doivent pas être trop dilués, ou bien ils jouent sur ces dilutions en appliquant plusieurs couches.
/image%2F2354072%2F20230613%2Fob_34f2c8_melanosome-serres.jpg)
Pour être efficaces comme pigments noirs, les mélanosomes doivent être très proches l’un de l’autre, voire serrés l’un contre l’autre.
Rappel : Le processus de kératinisation du cheveu en hélices et les écailles, très structurées, concentre effectivement les mélanosomes dans la kératine amorphe.
/image%2F2354072%2F20230612%2Fob_4953a5_fee-vecteur.jpg)
Cette proximité des pigments/mélanosomes est un paramètre essentiel de l’hypothèse de la « fée ferroélectrique ».
/image%2F2354072%2F20230612%2Fob_582c2c_blanc.jpg)
L’objectif d’un pigment blanc est exactement l’inverse de celui du pigment noir, il doit restituer, à l’œil humain, la totalité de la lumière (blanche, solaire).
Ci-contre, le pigment blanc d'oxyde de titane
Le colorant blanc n’existe pas puisqu’il correspondrait à la transmission de la totalité de la lumière … blanche ! Ce serait un colorant invisible !
La perception du blanc est produite par de la lumière blanche diffusée dans toutes les directions sans qu’une longueur d’onde particulière ne soit privilégiée. C’est la cas d’un mélange de particules de différentes tailles.
/image%2F2354072%2F20230528%2Fob_bb67f5_cheveu-keratine-amorphe.jpg)
Pour le cheveu, le blanc pourrait résulter de la diffusion de la lumière blanche par les structures kératiniques aussi différentes que celles les écailles et des proto-fibrilles.
Le blanc des cheveux, naturellement blancs, est très variable selon les individus.
Les cheveux peuvent restituer un aspect jaunâtre.
Jugé peu esthétique, ce jaune peut être atténué par du violet.
/image%2F2354072%2F20230612%2Fob_2123fb_mamie-cheveux-mauves.jpg)
Pour les coloristes, le pigment violet est complémentaire du pigment jaune.
Mais une « coloration »/pigmentation en violet doit être pratiquée avec art et prudence ... pour éviter de voir des « mamies aux cheveux mauves » comme on en croisait il y a une cinquantaine d’années !
Depuis les chimistes et les coiffeurs ont beaucoup progressé, notamment en tenant compte de la spécificité individuelle de chaque coiffure.
/image%2F2354072%2F20230630%2Fob_5dd31f_blanc-coleoptere.jpg)
La Nature peut nous offrir une blancheur étonnante, celle des écailles de la carapace de coléoptères asiatiques comme Lepidiota stigma.
/image%2F2354072%2F20230630%2Fob_2a7d53_blanc-coleoptere-02.jpg)
Le « blanc » est le résultat de diffusions et de réfractions sur des structures de chitines (glucides de la carapace) poreuses et contenant près de 70% d’air.
Bien que l’art de la décoloration des cheveux et celui de la coloration concernent toutes les deux la kératine amorphe, les cibles sont différentes :
/image%2F2354072%2F20230526%2Fob_398dad_decoloration-cheveux-02.jpg)
La décoloration pratiquée par les coiffeurs concerne la mélanine des pigments, par (per)oxygenation.
Quant à la coloration, les mêmes coiffeurs l’effectuent mais sur différents sites chimiques disponibles, également de la kératine amorphe.
Les autres structures de cheveux ne sont pas accessibles aux sites chimiques sur lesquels peuvent se fixer les molécules de colorants.
/image%2F2354072%2F20230529%2Fob_469523_coloration-de-la-laine.jpg)
La décoloration du cheveu est une dépigmentation, la coloration est une ... pigmentation produite par fixation d'une molécule colorante sur les kératines (amorphes) ...
... comme la teinture de la laine de mouton (ci-contre).
Une pontage chimique est souvent nécessaire pour fixer la teinture. Cette étape préalable, le mordançage, fait partie de l'art du teinturier. Les substances utilisées, les mordants, sont variées, ce sont par exemple de l’alun (sulfate double d’aluminium et de potassium), des sulfates de cuivre ou de fer, des tanins, …

/image%2F2354072%2F20230620%2Fob_ab5a2c_english-flag.jpg)
/image%2F2354072%2F20230612%2Fob_e765f0_fee-electricite.jpg)